Untuk mengetahui kandungan virus Gumboro (Infectious Bursal Disease) atau di kenal juga dengan nama IBD dalam suatu sediaan (cair maupun padat) dapat dilakukan dengan cara virus tersebut diencerkan dalam suatu larutan sampai peneipisan tertentu, kemudian masing-masing pengenceran/penipisan virus ditanam/ditumbuhkan pada telur berembrio, selanjutnya telur tersebut diinkubasi di suhu 37⁰C selama 5 - 6 hari. Larutan yang biasa dipakai untuk pengenceran virus menggunakan larutan Phosphat Buffer Saline (PBS), NaCl fisiologis, cara membuat larutan PBS silahkan baca artikel Prosedur Pembuatan Phosphat Buffer Salne
Alat dan Bahan
Untuk menghindari kontaminasi dari mikro organisma lain alat dan bahan-bahan yang berhubungan langsung dengan virus harus terlebih dahulu di sterilisasi. Alat dan bahan yang diperlukan adalah :
- Biosafety Cabinet
- Tabung reaksi
- Pipet steril Vol. 10 ml & 1 ml
- Spuit 1 ml
- Alat Pengocok (Vortex)
- Sprayer alcohol 70%
- Pembolong Telur (Puncher)
- Gunting
- Kaca plat
- Batang pengaduk (stick gelas)
- Candler
- Sampel virus Gumboro (Fluida (bulk) virus/Freez drying)
- 25 butir telur ayam SPF/Clean egg masa inkubasi 9 -11 hari
- Phosphat Buffer Saline (PBS)
- Silicon rubber/paraffin
- Kapas beralkohol 70%
Persiapan
Teropong (Candling) telur untuk mengetahui posisi embrio dan rongga udara, dengan menggunakan pensil beri tanda +3 mm diatas rongga udara, beri nama setiap telur sesuai dengan nama sampel dan tingkat penipisannya
Oles dengan kapas beralkohol pada area rongga udara.
Prosedur
1. Virus dalam Sedian Cair
- Disinfeksi area kerja BSC dengan kapas beralkohol 70%
- Tempatkan beberapa tabung reaksi di rak tabung dan beri nomor, jumlah tabung sesuai dengan kisaran titer virus Gumboro
- Pipet 4,5 ml PBS dan masukan pada masing-masing tabung
- Pipet 0,5 ml sample virus Infectious Bronchitis dan masukan kedalam tabung no 1 (10⁻¹) kocok sampai homogen dengan menggunakan vortex.
- Dari penipisan tabung pertama, pipet 0,5 ml dan masukan kedalam penipisan berikutnya (tabung no 2) kocok sampai homogen. Lakukan step ini sampai pada penipisan terendah
- Dengan menggunakan pembolong telur (puncher), lubangi telur di tanda silang (+ 3 mm diatas rongga udara)
- Inokulasikan penipisan fluida dari empat penipisan terendah sesuai dengan kisaran titer ND pada telur embrio tertunas umur 10 hari sebanyak 0.1 ml / butir telur, rute intra allantois, 5 butir setiap penipisan.
- Inokulasikan larutan PBS pada 5 butir telur embrio tertunas umur 10 hari masing-masing 0,1 ml (sebagai kontrol)
- Tutup lubang bekas inokulasi dengan sealent/paraffin
- Inkubasikan pada suhu 37⁰C selama 5 - 6 hari dan observasi setiap hari dengan cara diteropong dengan lampu pijar (candler), embrio yang mati 24 jam post inokulasi dianggap kematian yang tidak spesifik ( dibuang ). Embrio yang mati sesudah 48 jam dichilling pada suhu 4⁰C
- Pada akhir masa inkubasi telur yang hidup beserta telur yang mati dilihat perubahan embrio

2. Virus dalam Sedian Freeze Drying
Untuk virus yang penyimpanannya dalam bentuk Freeze Drying, sebelum dilakukan pengenceran (10⁻¹ dan seterusnya) virus dilarutkan terlebih dahulu dengan PBS sampai kandungannya 1 dosis (per 0,1 ml),
Cara mengencerkan virus menjadi 1 dosis
Dosis per vial
|
Pengenceran 10 ds/0.1 ml
|
Pengenceran 1 ds/0.1 ml
|
500
|
1 vial + 5 ml PBS
|
1 ml vaksin + 9 ml PBS
|
1000
|
1 vial + 10 ml PBS
|
1 ml vaksin + 9 ml PBS
|
2000
|
1 vial + 20 ml PBS
|
1 ml vaksin + 9 ml PBS
|
Selanjutnya dilakukan pengenceran mulai 10⁻¹ sampai penipisan terendah sesuai perkiraan titer virus yang terkandung (pengerjaannya seperti pada step pengenceran virus dalam bentuk cair)
Penilaian (Judgement)
- Dengan menggunakan gunting buka kerabang telur dari masing-masing pengenceran
- Keluarkan embrio dari telurnya
- Amati perubahan Pathologi Anatomi (PA) pada embrio
- Embrio positif terinfeksi virus Gumboro akan terjadi perubahan diantaranya embrio kemerahan (haemorhagi) kerdil, terjadi penimbunan di area rongga perut dan biasanya hati berwarna hijau
- Hitung titer virus menggunakan metode “Spearman – Karber”
- Perhitungan metode “Spearman – Karber” berdasarkan log 10 EID₅₀.
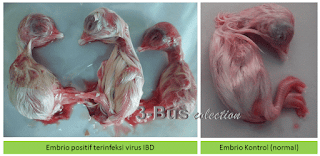
Perbedaan Embrio yang terinfeksi virus IB dan kontrol
Rumus :
EID50 = X + 1/2 - d∑ri atau
n
= X + 0,5 - d∑ri
n
Keterangan :
- X = Pengenceran tertinggi (konsentrasi terendah)
- ∑ri = Total yang tidak terinfeksi (negatif/normal)
- n = Jumlah telur/cell/mencit/ayam yang dipakai pada setip penipisan
- d = log dari factor penipisan (log 10 =1)
Contoh Hasil Penilaian VCT
Hasil Uji VCT Virus Gumboro (Infectious Bursal disease)
Pengenceran
|
Positif (kerdil/Hemohagi)
|
Negatif
|
10-4
|
5
|
0
|
10-5
|
5
|
0
|
10-6
|
3
|
2
|
10-7
|
1
|
4
|
Kontrol
|
0
|
5
|
Perhitungannya :
EID₅₀ = 7 + 0,5 - 6/5
= 7,5 - 1,2
= 6,3
maka titer virus Gumboro hasil dari uji kandungan virus adalah : 10⁶․³EID₅₀
Definisi
- Fluida (Bulk) adalah cairan alantois hasil panen dari telur yang telah ditanam virus Gumboro
- Telur SPF (Specific pathogen Free) adalah telur ayam yang tidak mempunyai antibodi berasal dari turunan ayam petelur yang tidak/belum pernah divaksinasi dan bebas dari penyakit mematikan.
- Clean Egg adalah telur ayam yang yang tidak mempunya antibodi tertentu
Pustaka
Farmakope Obat Hewan Indonesia Jilid I (sediaan Biologik) edisi 3 tahun 2013. Direktorat Jenderal Pertenakan Departemen Pertanian Republik Indonesia
Semoga Bermanfaat........









